人教版高中必学一化学期末模拟试题
试题说明:
选项 | 物质 | 使用的试剂 | 操作办法 |
A | NaCl(泥沙) | 水 | 过滤 |
B | CO2(CO) | O2 | 点燃 |
C | Fe(Zn) | 稀硫酸 | 结晶 |
D | CO2(HCl) | NaOH溶液 | 洗气 |
9.下列实验操作错误的是
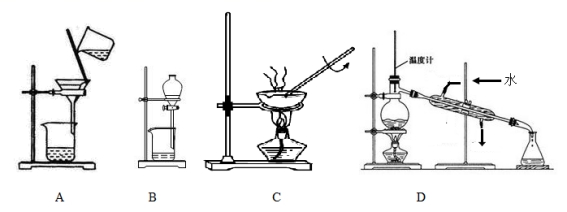
10.下列化学反应的离子方程式书写正确的是
A.碳酸钙溶解于盐酸:![]()
![]() B.单质铁与稀硫酸反应:
B.单质铁与稀硫酸反应:![]()
C.电解饱和食盐水制氯气:![]()
D.过量的二氧化碳通入氢氧化钠溶液:![]()
11.下列说法中,正确的是
A.碳酸钠溶液显碱性,所以碳酸钠是碱
B.某试样焰色反应呈黄色,则试样中含有K+
C.游泳场馆常用硫酸铜作池水消毒剂
D.碳酸钠是发酵粉的主要成分
![]() 12.工业上冶炼锡的第一步反应为
12.工业上冶炼锡的第一步反应为![]() ,则下列说法中错误的是
,则下列说法中错误的是
A.a的值为2 B.反应中SnO2被还原
C.反应后有两种氧化产物 D.1mol SnO2参加反应电子转移8mol
13.已知:①![]() ,②
,②![]() 。下列粒子的氧化性从强到弱的顺序为
。下列粒子的氧化性从强到弱的顺序为
A. Cl2 > Fe3+ > I2 B. I2 > Cl2 > Fe3+ C. Fe3+ > Cl2 > I2 D. Cl2 > I2 > Fe3+
14.铝元素在人体内积累可使人慢性中毒,铝及其化合物在下列场所用时都须加以控制的是
① 制炊具 ② 制防锈油漆 ③ 用明矾净水
④ 用明矾和苏打做食物膨化剂 ⑤ 用氢氧化铝制药
A. ①②③④⑤ B. ①③④⑤ C. ②③④ D. ②③④⑤
15.由硝酸钠、氯化钡和氯化钠组成的混合溶液,其中n(Na+)=0.4mol,n(Ba2+)=0.1mol,n(Cl-)=0.1mol,则n(NO3-)为
A. 0.1mol B. 0.3mol C. 0.5mol D. 0.15mol
16.下列氯化物既能够由氯气和金属反应制得,又可以由金属与盐酸反应制得的是
A. AlCl3 B. FeCl2 C. FeCl3 D. CuCl2
17.下列说法中错误的是
A.钠应保存在煤油中
B.钠与氧气反应的产物与反应条件有关
C.钠在反应中易失电子,表现出还原性
D.电解绿化率溶液可以得到金属铝
18.现有Na2SO4、NH4NO3、KCl、2SO4四种无色溶液,若用一种试剂将它们不同开来,该试剂是(必要时可以加热)
A. BaCl2 B. Ba2 C. NaOH D. AgNO3
19.在标准情况下,由CO和CO2组成的混合气体,体积为15.68L,水平为24.4g,此混合气体中C和O两种原子的物质的量之比为
A. 7 ∶10 B. 2 ∶1 C. 4 ∶3 D. 5 ∶2
20.下面实验策略设计的最严密的是
A.检验试液中的SO42-:![]()
B. 检验试液中的Fe2+:![]()
C. 检验试液中的I-:![]()
D. 检验试液中的CO32-:![]()
第II卷(非选择题 共60分)
2、填空题(本题包含4个小题,共31分)
21.(9分)现有六种物质:①Cl2 ②CaO ③Na2CO3溶液 ④蔗糖 ⑤BaCl2晶体 ⑥CO2
⑴是电解质的是__________________(填序号,下同);是非电解质的是_________。
⑵是碱性氧化物的是_________________。
⑶写出⑤溶于水的电离方程式__________________________________。
⑷写出③与⑥反应的化学方程式________________________________。
22.(6分)铁的化合物应用很广泛,刻制印刷电路板时要用FeCl3溶液为腐蚀液,其反应的化学方程式为:![]()
⑴该反应的氧化剂是_______________________(填化学式)。
⑵请用双线桥法标出该反应电子的转移的方向和数目。
![]()
⑶用过的腐蚀液会失效,但还可以收购借助,其中有一步需要将Fe2+转化为Fe3+,下列试剂能达成上述变化的是_____________________________(填序号)。
①氯气 ②铁 ③盐酸 ④稀硫酸
⑷某久置的FeCl2溶液略显黄色,某同学觉得可能有部分Fe2+被氧化为Fe3+,因此配制FeCl2溶液时需加少量铁粉,请写出Fe3+转化为Fe2+的离子方程式____________________。
23.(9分)漳州海水资源丰富,漳浦盐场是福建第三大国有盐场,盐田面积达700万平米,每年产盐5万多吨。海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的借助具备很广阔的前景。
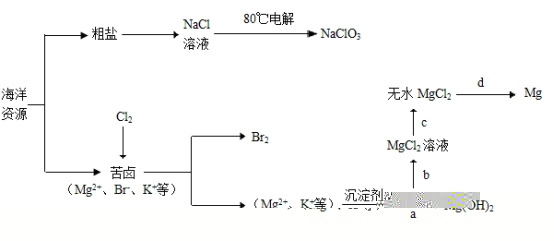
回答下列问题:
⑴NaClO3中氯的化合价_____________。
⑵在a、b、c、d提取镁的过程中,没涉及的化学反应种类是_________(填序号)。
①分解反应 ②化合反应 ③复分解反应 ④置换反应
⑶苦卤中通入氯气发生的主要离子反应方程式为___________________________________。⑷步骤a中的沉淀剂是____________________。
⑸步骤d中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是____________(填序号)。
 ①未洗涤烧杯内壁和玻璃棒
①未洗涤烧杯内壁和玻璃棒 
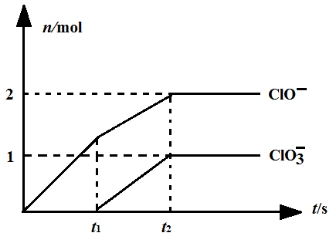 ⑹肯定温度下,向NaOH溶液中通入适量的氯气,二者恰好完全反应。生成物中含有三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。
⑹肯定温度下,向NaOH溶液中通入适量的氯气,二者恰好完全反应。生成物中含有三种含氯元素的离子,其中ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示。 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
答案 | C | A | C | D | D | C | B | A | D | C |
题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
答案 | C | D | A | B | C | A | D | B | A | C |

 ⑷ ①④
⑷ ①④ 






